Schutzschilde gegen die pflanzliche Abwehr
Wie sich ein Pilz vor der feindlichen Umgebung schützt, in der er sich nach einer Infektion von Maispflanzen befindet
Der Pilz Ustilago maydis verursacht die Maisbeulenbrandkrankheit. Bei der Infektion von Maispflanzen wird der Pilz durch das pflanzliche Immunsystem erkannt, welches den Eindringling durch einen Cocktail von Abwehrmolekülen angreift. Wissenschaftler des Max-Planck-Instituts für terrestrische Mikrobiologie in Marburg haben entdeckt, wie sich der Pilz vor der antimykotischen Aktivität zweier Proteine in diesem Cocktail schützt. Sie zeigen, dass diese Maisproteine nicht nur U. maydis angreifen, sondern auch andere pilzliche Krankheitserreger, die auf Mais parasitieren. Diese Entdeckung erlaubt tieferen Einblick in das erstaunliche Zusammenspiel zwischen einem Pathogen und seinem Wirt und bietet neue Möglichkeiten der Krankheitsbekämpfung.
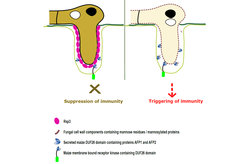
Um eine Pflanze erfolgreich zu besiedeln, sekretiert U. maydis mehrere hundert Effektorproteine, die die Abwehrreaktionen der Pflanze unterdrücken und die Entwicklung und den Metabolismus des Wirtes zu Gunsten des Pilzes neu programmieren. Bei der Mehrzahl dieser Effektoren handelt es sich um neuartige Moleküle ohne bekannte Motive, die für eine Funktionsvorhersage hilfreich wären. Die Herausforderung besteht daher darin, ihre biochemische Funktion aufzuklären, um zu verstehen, wie Effektoren zur Etablierung des Pilzes im pflanzlichen Gewebe und somit zum Fortschreiten der Krankheit beitragen. Einer dieser neuartigen Effektoren ist Rsp3, ein sehr ungewöhnliches Protein, dessen C-terminale Hälfte aus einer komplexen Anordnung mehrerer verschiedener repetitiver Einheiten besteht. Ein Vergleich von rsp3 Genen verschiedener Feldisolate von U. maydis ergab starke Längenpolymorphismen, welche durch Deletionen und Rearrangements innerhalb der repetitiven Domäne entstanden sind. rsp3 wird während der Kolonisierung der Pflanze stark exprimiert, und die Deletion des Gens führt zu einem massiven Virulenzverlust des Pilzes. Durch Immunfärbung infizierter Pflanzen wurde Rsp3 ausschließlich auf der Oberfläche von im Pflanzengewebe wachsenden Hyphen nachgewiesen. Biochemisch wurde gezeigt, dass Rsp3 mit zwei sezernierten DUF26-Domänenfamilienproteinen aus Mais, die als AFP1 und AFP2 bezeichnet werden, interagiert. Diese Proteine sind mit einem Mannose-bindenden antimykotisch wirkenden Protein aus Ginkgo biloba verwandt. Das AFP1 Protein bindet ebenfalls Mannose und wirkt als Fungizid gegen die rsp3 Deletionsmutante, nicht jedoch gegen einen U. maydis Stamm, dessen Zellwand mit Rsp3 Protein dekoriert ist. In Maispflanzen, in denen die Expression der AFP1 und AFP2 Gene unterdrückt wurde, konnte der Virulenzdefekt der rsp3 Mutante partiell aufgehoben werden. Dies zeigt, dass die Blockierung der antimykotischen Aktivität von AFP1 und AFP2 durch Rsp3 die zentrale Aufgabe des Rsp3 Effektors ist. Die Tatsache, dass mit Rsp3 verwandte Proteine in allen Brandpilzen vorhanden sind, deutet darauf hin, dass dieser neu entdeckte Schutzmechanismus konserviert ist. Interessanterweise konnte gezeigt werden, dass Maispflanzen, in denen die Expression von AFP1 und AFP2 unterdrückt wurde, auch anfälliger für den Pilz Colletotrichum graminicola werden, einem nicht mit U. maydis verwandten Pilz, der Anthracnose-Stengelfäule und Blattfäule in Mais verursacht. Dies zeigt, dass die antimykotisch wirkenden Maisproteine, die in dieser Studie entdeckt wurden, eine generelle Rolle bei der pflanzlichen Abwehr von Pilzen spielen, die Pflanzenkrankheiten verursachen.
Originalpublikation:
Ma, L.-S., Wang, L., Trippel, C., Mendoza-Mendoza, A., Ullmann, S., Moretti, M., Carsten, A., Kahnt, J., Reissmann, S., Zechmann, B., Bange, G. and Kahmann, R. (2018)
The Ustilago maydis repetitive effector Rsp3 blocks the antifungal activity of mannosebinding maize proteins
Nature Communications 9:1711
doi: 10.1038/s41467-018-04149-0












