Wie Archaeen der Thermodynamik ein Schnippchen schlagen
Mevalonat ist ein Ausgangsstoff zur Synthese vieler Chemikalien in der Industrie und ein Lipid-Baustein aller Archaeen. Der erste Schritt in der Biosynthese ist jedoch thermodynamisch schwierig zu bewerkstelligen. Wissenschaftlerinnen und Wissenschaftler vom Max-Planck-Institut für terrestrische Mikrobiologie in Marburg und Kooperationspartner aus Frankreich entdeckten einen cleveren Trick, welcher es Archaeen ermöglicht, schnell und effizient Mevalonat herzustellen. Archaeen koppeln dazu den ersten Schritt der Synthese an einen zweiten Schritt, welcher die ganze Reaktion antreibt. Die Entdeckung zeigt nicht nur, mit welchen Methoden die Natur solche schwierigen Reaktionen meistern kann, sondern bietet auch neue Möglichkeiten zur Optimierung der industriellen Mevalonatproduktion.
Für die Synthese von Lipiden der Archaeen (Isoprenoide) wird Mevalonat als Baustein benötigt. Jedoch ist der erste enzymatische Schritt (Thiolase) im Biosyntheseweg von Mevalonat thermodynamisch ungünstig und deshalb sehr langsam. Da Archaeen jedoch für ihr Wachstum viel Mevalonat benötigen, stellte sich die Frage, wie sie dieses thermodynamische Problem lösen. Um diese Frage zu beantworten, arbeiteten die Wissenschaftlerinnen und Wissenschaftler mit dem Archaeon Methanothermococcus thermolithotrophicus und isolierten aus seinem Proteom die Thiolase. Überraschenderweise fanden sie die Thiolase mit zwei weiteren Proteinen in einem Proteinkomplex vor. Dieser bestand aus der Thiolase, dem zweiten Enzym aus dem Mevalonat-Stoffwechselweg, der HMG-CoA Synthase (HMGCS) und einem kleinen, dritten, bisher nicht charakterisiertem Protein aus der DUF-35 Proteinfamilie.
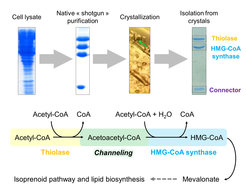
Strategie zur Isolierung und Charakterisierung des nativen Thiolase/HMG-CoA-Synthase-Komplexes (oben) und der Reaktion, die durch den Komplex erfolgt (unten).
In einem kombinierten Ansatz aus Biochemie und Röntgenkristallographie wurden die molekularen Geheimnisse der Hochdurchsatzbiosynthese aufgedeckt: die Thiolase und die HMGCS teilen sich die Bindetasche für das Zwischenprodukt Acetoacetyl-CoA. Dieses kann dadurch sehr effizient von einem Enzym ans nächste weitergereicht werden, was zu einer Koppelung der beiden Reaktionen führt.
Diese Entdeckung ist für die industrielle Anwendung von enormer Wichtigkeit, da Mevalonat als Baustein vieler interessanter Moleküle begehrt ist. Eine Anwendung der Strategie, die Archaeen nutzen, könnte es ermöglichen, die Mevalonat-Produktion in industriellen Produktionsstämmen zu erhöhen. Interessant ist auch, dass der beschriebene Enzymkomplex in den meisten Archaeen und vielen Bakterien vorkommt. Die Strategie der Koppelung chemischer Reaktionen in der Natur wird demnach von vielen Organismen verwendet.
Diese Entdeckung wurde ermöglicht durch die Zusammenarbeit von Dr. Seigo Shima und Dr. Tobias Erb vom Max-Planck-Institut für terrestrische Mikrobiologie Marburg, dem Institut de Biologie Structurale (IBS, Grenoble) mit Eric Girard und der École Normal Supérieure de Chimie in Lyon (ENS, Lyon) mit Oliver Maury.
Originalpublikation:
Vögeli, B.; Engilberge, S.; Girard, E.; Riobé, F.; Maury, O.; Erb, T.; Shima, S. and Wagner, T. (2018)
Archaeal acetoacetyl-CoA thiolase/HMG-CoA synthase complex channels the intermediate via a fused CoA-binding site.
PNAS 2018 Mar 12. pii: 201718649. doi: 10.1073/pnas.1718649115












