Produktion von H2O2 aus H2 und O2
Das Enzym Hydrogenase katalysiert die Produktion und Nutzung von Wasserstoffgas, welches als Energieträger der Zukunft gilt. Wissenschaftlerinnen und Wissenschaftler vom Max-Planck-Institut für terrestrische Mikrobiologie in Marburg haben zusammen mit Kooperationspartnern aus anderen Instituten entdeckt, dass [Fe]-Hydrogenase H2O2 aus H2 und O2 produziert. Diese Erfindung ist entscheidend, um den katalytischen Mechanismus dieses Enzyms zu verstehen und um neue H2O2-bildende Katalysatoren zu entwickeln.
[Fe]-Hydrogenase vermittelt den reversiblen Hybridtransfer von H2 auf eine organische Verbindung. Diese katalytische Fähigkeit macht [Fe]-Hydrogenase zu einem attraktiven Modellsystem für das Design mimetischer Hydrierungskatalysatoren. Bis heute wurden bereits zahlreiche mimetische Verbindungen des aktiven Zentrums der [Fe]-Hydrogenase synthetisiert. Um deutlich überlegene mimetische Verbindungen zu designen, ist ein tieferes Verständnis der Reaktion der [Fe]-Hydrogenase auf atomarer Ebene notwendig.
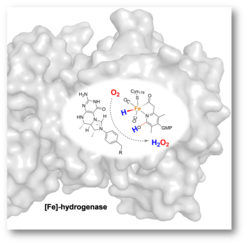
Für die industrielle Verwendung von Hydrogenasen und ihren mimetischen Katalysatoren ist die Sensibilität für O2 ein zu beachtendes Problem, da die meisten Hydrogenasen ihre Aktivität in der Anwesenheit von O2 verlieren. Die Arbeitsgruppe von Seigo Shima am Max-Planck-Institut für terrestrische Mikrobiologie hat zusammen mit Ulrich Ermler vom Max-Planck-Institut für Biophysik, Eckhardt Bill vom Max-Planck-Institut für chemische Energiekonversionen und Kenichi Ataka von der Freien Universität Berlin entdeckt, dass [Fe]-Hydrogenase nur dann durch O2 inaktiviert wird, wenn reduzierende Substanzen anwesend sind. Das zugesetzte O2 wurde in H2O2 umgewandelt, welches das Enzym aggressiv inaktiviert. Dieses Ergebnis zeigte, dass O2 während der katalytischen Reaktion durch ein Intermediat der [Fe]-Hydrogenase zu H2O2 reduziert wird (s. Abbildung). Dies ist der erste experimentelle Beweis für das Vorliegen eines O2-reaktiven Eisen-Hybrid-Intermediats im Katalysezyklus von [Fe]-Hydrogenase, welches für das Verständnis des genauen Reaktionsmechanismus von Bedeutung ist. Darüber hinaus eröffnet dieses Ergebnis einen neuen Weg für die Entwicklung eines biomimetischen H2O2-produzierenden Katalysators, einer wichtigen industriellen Verbindung. H2O2 wird kommerziell durch ein indirektes chemisches Verfahren unter Verwendung von Ni oder Pd als Katalysator hergestellt, wobei saubere und direkte Verfahren bevorzugt werden. [Fe]-Hydrogenase katalysiert mechanistisch nur eine Reduktion von zwei Elektronen mit einem Hydridtransfer, daher sollte diese katalytische Reaktion selektiv H2O2 produzieren. Diese chemischen Eigenschaften könnten für die Entwicklung eines neuen H2O2-bildenden Katalysators genutzt werden.
Originalpublikation:
Huang, G., Wagner, T., Ermler, U. Bill, E., Ataka, K. & Shima, S. (2018)
Dioxygen sensitivity of [Fe]-hydrogenase in the presence of reducing substrates. Angewandte Chemie International Edition. DOI: 10.1002/anie.201712293 and 10.1002/ange.201712293.











![Schutz der [Fe]-Hydrogenase](/416963/teaser-1543249294.jpg?t=eyJ3aWR0aCI6MzYwLCJoZWlnaHQiOjI0MCwiZml0IjoiY3JvcCIsImZpbGVfZXh0ZW5zaW9uIjoianBnIiwib2JqX2lkIjo0MTY5NjN9--a2cbc915dead8f614cb714f7698e84b376a4f59c)