Molekulare Zeitreise
Hinter der Evolution komplexer Proteine, die ohne Funktion sind, steht ein universeller biochemischer Mechanismus
Komplexe Proteinstrukturen können sich über evolutionären Zeiträume hinweg in der Natur erhalten und in ihrer Vielfalt ansammeln, selbst wenn sie keine Funktion besitzen, weil ein universeller molekularer Mechanismus ihre natürliche Auslese verhindert. Wie die Rekonstruktion uralter Proteine sowie Mutationsexperimente im Labor zeigten, unterliegt die entstandene Komplexität dem Prinzip einer Ratsche - das Zurückrutschen in frühere Zustände ist versperrt. Dr. Georg Hochberg, jetzt Gruppenleiter am Max-Planck-Institut für terrestrische Mikrobiologie in Marburg, und seine Forscherkollegen von der Universität Chicago veröffentlichten ihre Ergebnisse in der neuesten Ausgabe der Zeitschrift "Nature".
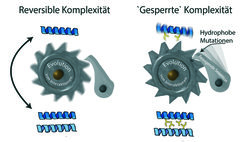
Ein biochemischer Mechanismus nach Art einer Ratsche macht die Evolution nutzloser Komplexität unumkehrbar. Links: Wenn eine Interaktion zwischen zwei Proteinen in der Evolution entsteht, dann haben solche Interaktionen zunächst oft keinen funktionellen Nutzen und können ohne Folgen verloren gehen. Rechts: Die Teile des Proteins, die in der Interaktionsstelle verborgen sind, können schnell hydrophobe Mutationen (gelbe Stäbchen) in einem Ausmaß anreichern, das schädlich wäre, wenn sie der wässrigen Umgebung der Zelle ausgesetzt wären. Die negative Selektion verhindert die Umkehrung zurück in einen einfacheren Zustand.
Häufig wird angenommen, dass Komplexität von Strukturen und Prozessen grundsätzlich auf der Selektion von Vorteilen beruht. Das galt auch für die Proteine unserer Zelle, von denen die meisten spezifische Komplexe mit anderen Proteinen bilden, ein Vorgang, den man Multimerisation nennt.
"Wie sich Komplexität entwickelt, ist eine der großen Fragen der Evolutionsbiologie", erklärt Joseph Thornton, Professor für Humangenetik und Ökologie und Evolution an der Universität Chicago. "Die klassische Erklärung ist, dass ausgeklügelte Strukturen existieren müssen, weil sie dem Organismus einen funktionellen Nutzen verleihen, so dass die natürliche Selektion immer komplexere Zustände hervorbringt. In einigen Fällen ist Komplexität tatsächlich klar adaptiv, wie die Evolution des Auges - komplexe Augen sehen besser als einfache. Aber auf molekularer Ebene haben wir herausgefunden, dass es andere, einfache Mechanismen gibt, die zur Anreicherung von Komplexität führen."
Ein internationales Forschungsteam unter der Leitung von Prof. Thornton von der University of Chicago und Dr. Georg Hochberg vom Max-Planck-Institut für terrestrische Mikrobiologie in Marburg machte sich daran, die Evolution der Multimerisierung in einer Familie von Proteinen zu untersuchen, den so genannten Steroidhormonrezeptoren. Diese setzen sich typischerweise zu Paaren (so genannten Dimeren) zusammen. Die Forschenden haben dazu eine Technik namens Vorläufer-Protein-Rekonstruktion verwendet, laut Thornton eine Art molekulare "Zeitreise", die es ihnen erlaubte, ehemalig vorkommende Proteine im Labor nachzubilden und experimentell zu untersuchen, wie diese vor Hunderten von Millionen Jahren von Mutationen betroffen gewesen wären. Zu ihrer Überraschung stellten sie fest, dass diese Proteine durch den Zusammenbau zu einem Dimer nicht anders funktionierten, als wenn sich die Dimerisierung überhaupt nie entwickelt hätten. Die Bildung des Komplexes war weder nützlich noch vorteilhaft.
Doch warum existierte die dimere Form dann über 450 Millionen Jahre? Die Forschenden fanden eine überraschend einfache Lösung. „Die Proteine wurden im Laufe der Zeit abhängig von ihrer Interaktion, auch wenn sie überhaupt nicht nutzbringend war“, erklärt Dr. Georg Hochberg, Leiter der Max Planck Forschungsgruppe "Evolutionary Biochemistry" in Marburg. „Im Bereich der Bindestellen konnten sich bei den beteiligten Interaktionspartnern Mutationen ansammeln, die im Solo-Zustand vernichtend gewesen wären, aber durch die Dimerisierung tolerabel wurden. Das machte diese Proteinvarianten total abhängig von der Dimer-Form, und es gab für sie keinen Weg zurück. Wie bei einer Ratsche war die sinnlose Evolution eingerastet– praktisch für immer – und es gab keinen Weg zurück.“
Mittels Analyse einer riesigen Datenbank von Proteinstrukturen zeigten die Forschenden, dass der genetische Code diese "evolutionäre Ratsche" universell macht. Sie fanden das Prinzip auf einer grundlegenden Ebene der Zelle verwirklicht: dem Zusammenspiel von Fett- und Wasserlöslichkeit. Mutationen, die die Oberfläche eines Proteins unlöslicher machen, beeinträchtigen seine Faltung; wenn sie bei Soloproteinen auftreten, werden sie durch Selektion entfernt. Sobald sich ein Protein jedoch zur Multimerisierung entwickelt, werden die Teile der Oberfläche, die die Grenzfläche bilden, vor Wasser verborgen, so dass unlösliche Mutationen nicht mehr schädlich sind; sie werden für die Selektion unsichtbar und können zu einem festen Bestandteil des Proteins werden. Die Rückkehr in den Solo-Zustand ist versperrt, denn sie würde die nachteilige Grenzfläche freilegen.
Die hydrophobe Ratsche, die seit Hunderten von Millionen von Jahren an Tausenden von Proteinen arbeitet, könnte die allmähliche Anhäufung vieler nutzloser Komplexe im Inneren von Zellen vorantreiben. "Einige Komplexe haben sicherlich wichtige Funktionen, aber selbst diese werden durch die hydrophobe Ratsche verschanzt, so dass sie schwerer zu verlieren sind, als sie es sonst wären", vermutet Hochberg. "Da die Sperre ständig im Hintergrund wirkt, haben unsere Zellen einen massiven Bestand an eingelagerten Komplexen aufgebaut, von denen viele nie eine nützliche Funktion erfüllt haben oder bereits lange nicht mehr erfüllen.“
Für die Zukunft ist zu untersuchen, ob andere Wechselwirkungen als die Multimerisierung das Ergebnis einer Verankerung sein könnten. "Hier ging es um die Dimerisierung von Proteinen mit anderen Kopien von sich selbst, ein sehr regulärer Prozess ", sagt Thornton. "Aber es gibt noch viele andere Interaktionen in Zellen, und wir halten es für möglich, dass sich einige davon im Laufe der Evolution aufgrund einer ähnlichen Art von erworbener Abhängigkeit von molekularer Komplexität angesammelt haben.“
(verändert nach: University of Chicago Press Release, Alison Caldwell)












