Fotosynthese im Tropfen
Forschende entwickeln einen „künstlichen Chloroplasten“
Pflanzen können es bereits seit Jahrmillionen: Kohlendioxid aus der Luft mithilfe von Sonnenenergie nutzbar machen. Künstliche Zellen als nachhaltige und umweltschonende Bioreaktoren zu bauen, dieser Herausforderung ist das Max-Planck-Forschungsnetzwerk MaxSynBio auf der Spur. Einem Max-Planck-Forscherteam um Tobias Erb vom Institut für terrestrische Mikrobiologie in Marburg ist es nun gelungen, eine Plattform zum automatisierten Bau zellgroßer Fotosynthese-Module zu entwickeln. Die „künstlichen Chloroplasten“ sind in der Lage, das Treibhausgas Kohlendioxid mittels Lichtenergie zu binden und umzuwandeln. Seine Ergebnisse veröffentlichte das Forscherteam in der jüngsten Ausgabe der Fachzeitschrift Science.
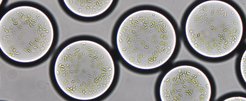
Mikrotröpfchen von ungefähr 90 Mikrometern Durchmesser und mit den gewünschten Enzymen ausgestattet, nutzen die semi-synthetischen Chloroplasten pflanzliche Thylacoid-Membranen zur Energieerzeugung. Sie fixieren auf diese Weise nach dem Vorbild der Natur Kohlendioxid mittels Sonnenenergie.
Einleitung
Über Milliarden von Jahren entwickelten Mikroorganismen und Pflanzen den ebenso genialen wie komplexen Prozess, den wir als Fotosynthese bezeichnen. Die Umwandlung von Sonnenenergie in chemische Energie versorgt alles Leben auf der Erde mit Nahrung und Sauerstoff. In höheren Pflanzen geschieht dies in zellulären Kompartimenten, den Chloroplasten. Der künstliche Nachbau des Photosynthese-Prozesses gilt als eine Art "Apollo-Projekt“ unserer Zeit: er würde bedeuten, Kohlenstoffverbindungen wie Antibiotika und andere Produkte nachhaltig aus Licht und Kohlendioxid herstellen zu können.
Doch wie konstruiert man eine künstliche, fotosynthetisch aktive Zelle? Der Schlüssel liegt darin, ihre wesentlichen Komponenten zum richtigen Zeitpunkt am richtigen Ort zusammenwirken zu lassen. Die Max-Planck-Gesellschaft verfolgt dieses Ziel im Rahmen des interdisziplinären Forschungsnetzwerks MaxSynBio. Nun ist es seinem Marburger Forscherteam um Direktor Tobias Erb gelungen, eine Plattform zum automatisierten Bau zellgroßer photosynthetisch aktiver Kompartimente zu schaffen. Die damit erzeugten "künstlichen Chloroplasten“, sind in der Lage, das Treibhausgas CO2 mittels Licht einzufangen und umzuwandeln.
Mikrofluidik trifft Synthetische Biologie
Dazu vereinte das Max-Planck-Team zwei neue Technologien: erstens die synthetische Biologie, für die Konstruktion neuartiger biochemischer Reaktionsnetzwerke, und zweitens Mikrofluidik, eine Nanotechnologie für das Erzeugen zellähnlicher Strukturen aus flüssigen Materialien.
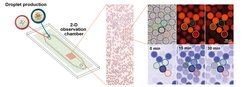
Mikrofluidik-Plattform zur Produktion von Mikrotropfen und ihrer Untersuchung in Echtzeit. Die Mikrotröpfchen werden in einer Kammer gesammelt und ihre Aktivität mikroskopisch überprüft, einschließlich Quantifizierung der enzymatischen Aktivität durch Messung der NADPH-Fluoreszenz. Mit Hilfe des Hellfeldes werden die Tröpfchen lokalisiert, die photosynthetisch aktiven Membranen sind sichtbar. Diese Membranen fluoreszieren bei Anregung durch Licht bestimmter Wellenlängen (oben rechts). Unterschiedlich ausgestattete Tröpfchenpopulationen lassen sich mit Hilfe eines kodierenden Farbstoffs unterscheiden (Anregung bei 550 nm). Die NADPH-Produktion der Tröpfchen ist mittels NADPH-Fluoreszenz (bei 365 nm) nachweisbar.
„Als allererstes benötigten wir ein Energiemodul, das es uns erlaubt, chemische Reaktionen nachhaltig zu betreiben. Bei der Fotosynthese liefern Chloroplasten-Membranen die Energie für die Kohlendioxid-Fixierung. Ihre Fähigkeiten wollten wir nutzen", erklärt Tobias Erb.
Der aus der Spinatpflanze isolierter Photosynthese-Apparat zeigte sich robust genug, um im Reagenzglas Einzelreaktionen und komplexere Reaktionsnetzwerke mit Licht antreiben zu können. Für die Dunkelreaktion setzten die Forschenden den von ihnen selbst entwickelten CETCH-Zyklus ein. Dieses künstliche Stoffwechselmodul besteht aus 18 Biokatalysatoren, die Kohlendioxid effizienter umwandeln als der in Pflanzen natürlich entstandene Kohlenstoffmetabolismus. Nach mehreren Optimierungsrunden gelang dem Team in Marburg die lichtgesteuerte Fixierung des Treibhausgases CO2 in vitro.
Die zweite Herausforderung war der Zusammenbau des Systems innerhalb eines definierten Kompartiments im Mikromaßstab. Auch sollte die Produktion im Hinblick auf spätere Anwendungen einfach automatisierbar sein. In Zusammenarbeit mit dem Labor von Jean-Christophe Baret vom Centre de Recherché Paul Pascal (CRPP) in Frankreich entwickelte dasTeam in Marburg eine Plattform für die Einkapselung der semi-synthetischen Membranen in zellähnliche Tröpfchen.
Effizienter als der natürliche Fotosynthese-Prozess
Die entstandene Mikrofluidik-Plattform ist in der Lage, Tausende standardisierter Tröpfchen zu produzieren, die je nach den gewünschten Stoffwechselfähigkeiten individuell ausgestattet werden können. "Wir können eine Vielzahl identisch ausgestatteter Tröpfchen herstellen, oder einzelne mit spezifischen Eigenschaften versehen", sagt Tarryn Miller, Erstautorin der Studie. "Diese lassen sich zeitlich und räumlich mittels Licht steuern.“
Im Gegensatz zur traditionellen Gentechnik am lebenden Organismus bietet der Bottom-up-Ansatz entscheidende Vorteile: Er konzentriert sich auf minimales Design, und er ist nicht notwendigerweise auf die Grenzen der natürlichen Biologie beschränkt. "Die Plattform erlaubt es uns, neuartige Lösungen zu realisieren, die die Natur während der Evolution nicht erforscht hat", erklärt Tobias Erb. Nach seiner Einschätzung bergen die Ergebnisse viel Zukunftspotenzial. So konnten die Autorinnen und Autoren in ihrer Publikation im Fachmagazin „Science“ zeigen, dass der „künstliche Chloroplast“ mithilfe der neuartigen Enzyme und Reaktionen Kohlendioxid 100-mal schneller bindet als bisherige synthetisch-biologische Ansätze. "Langfristig könnten lebensechte Systeme in praktisch allen technologischen Bereichen Anwendung finden, einschließlich Materialwissenschaften, Biotechnologie und Medizin - wir stehen erst am Anfang dieser aufregenden Entwicklung.“ Die Ergebnisse sind auch ein weiterer Schritt zur Bewältigung einer der größten Herausforderungen der Zukunft: die der ständig steigenden Konzentrationen von atmosphärischem Kohlendioxid.













