Selbstorganisation und Selbstpositionierung bakterieller Proteincluster
Viele Zellprozesse setzen voraus, dass die Proteine in der Zelle präzise positioniert sind. Das ist sogar der Fall, wenn die Proteine sich dynamisch verhalten und sich nicht auf bestehende zelluläre Landmarken verlassen. Wissenschaftler am Max-Planck-Institut für terrestrische Mikrobiologie in Marburg haben ein neuartiges physikalisches Modell vorgeschlagen, das beantwortet, wie solche dynamischen Proteine in den Bakterienzellen sich selbst in diesen sich regelmäßig wiederholenden Mustern organisieren können. Ihre Ergebnisse erschienen heute in der Fachzeitschrift „Nature Physics“.
Obwohl viele Proteine durch eine bestehenden Landmarke oder das Erkennen der Membrankrümmung eingefangen werden können, ist das nicht immer der Fall. In stäbchenförmigen Bakterien sind mehrere Proteinkomplexe regelmäßig entlang der Zelle angeordnet, obwohl kein Rekrutierungsfaktor bekannt ist. Seán Murray und Victor Sourjik haben ein Modell vorgeschlagen, das beantwortet, wie die Selbstorganisation und Selbstpositionierung von mit dem Nucleoid in Verbindung stehenden dynamischen Komplexen von statten gehen könnte. In kurzen Zellen findet sich der Fokuspunkt für den Mechanismus zuverlässig in der Mitte der Zelle, in längeren Zellen befindet er sich an jeder Viertelposition und dies lässt sich bei steigender Länge so weiter beobachten. Das Wachstum des Nucleoids führt desweiteren natürlich zu einer Aufteilung der Fokuspunkte und einer dynamischen Anpassung des Musters.
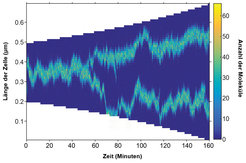
Selbstorganisation und Musterbildung sind in der Biologie meist durch den Turing-Mechanismus erklärt worden, einen physikalischen Effekt, durch den miteinander interagierende Moleküle die homogenisierende Wirkung der Diffusion überwinden können, um Regionen mit hoher Dichte zu bilden. Der Effekt kann zwar erklären, warum sich ein Muster bildet, er kann jedoch nicht vorgeben, welches Muster sich bildet. Die Autoren lösten dieses Problem, indem sie den Turing-Mechanismus mit einem Positionierungsmechanismus verbanden, der auf dem Austausch von Molekülen zwischen den Chromosomen (Nucleoid) und dem Cytosol basiert. Daraus ergibt sich, dass ausschließlich regelmäßig positionierte Muster auftreten. Im Wesentlichen ermöglicht der Mechanismus Proteinen, die Länge des Nucleoids zu erkennen und sich entsprechend zu positionieren.
Die Autoren verwenden das Modell, um die bei Escherichia coli beobachtete Selbstorganisation des SMC-Proteins zu erklären, welches ein wesentliches Protein bei der Organisation von DNA darstellt und in allen Domänen des Lebens zu finden ist. Sie merken zudem an, dass das Modell aufgrund seiner Allgemeingültigkeit wahrscheinlich auch auf andere regelmäßig positionierte, jedoch dynamische Proteine wie jene, die die Zellteilung stäbchenförmiger Bakterien steuern, anwendbar ist.
Referenz:
Murray, S.M. & Sourjik, V. (2017) Self-organization and positioning of bacterial protein clusters. Nature Physics, 1745-2481
