Assemblierung und Funktion von Zelloberflächenstrukturen in Archaeen
Forschungsbericht (importiert) 2009 - Max-Planck-Institut für terrestrische Mikrobiologie
Einführung
Archaeen bilden neben den Bakterien und Eukaryoten die dritte Domäne des Lebens. Früher wurde angenommen, dass Archaeen hauptsächlich unter extremen Umweltbedingungen wie z.B. Salzseen oder heißen Quellen leben, man weiß heute aber, dass ein großer Anteil der Mikroorganismen im Boden und in den Ozeanen zu den Archaeen zählt. Obwohl sie phänotypisch Bakterien ähnlich sind, verlaufen viele Prozesse wie DNA-Replikation, Transkription und Translation wie in Eukaryoten.
Die Zelloberfläche der meisten Archaeen besteht aus einem zweidimensionalen Proteinkristall, dem so genannten S-Layer. Das S-Layer verleiht den Zellen Stabilität, denn sie besitzen keine Zellwand, wie dies bei Bakterien typisch ist. Zelloberflächenstrukturen, wie z.B. Flagellen und Pili, sind in der Zytoplasmamembran verankert und müssen das S-Layer durchqueren.
Flagellen dienen nicht nur der Bewegung

Flagellen sind bei Bakterien vor allem für die Bewegung in Flüssigkeiten und über Oberflächen notwendig, sie sind aber auch bei der Anheftung an verschiedenste Oberflächen beteiligt. Pili, im speziellen Typ IV-Pili, spielen eine große Rolle bei der Wirtserkennung und Invasion von pathogenen Bakterien, bei der Motilität auf Oberflächen und beim DNA-Transfer. Obwohl man weiß, dass Archaeen ebenfalls Flagellen, Pili und andere einzigartige Zelloberflächenstrukturen besitzen, ist bisher nur wenig über die Assemblierung dieser Strukturen in der Membran von Archaeen und deren Funktion bekannt.
In der Arbeitsgruppe werden die Vertreter des Genus Sulfolobus als Modellorganismen verwendet. Verschiedene Sulfolobus-Arten wurden in unterschiedlich geothermal aktiven Gebieten wie z.B. dem Yellowstone Nationalpark (USA), den Solfatara Feldern (Neapel, Italien) und in heißen Quellen in Japan gefunden. Die optimalen Wachstumsbedingungen von Sulfolobus spp. sind 75-80 oC bei einem pH-Wert von 2-3. Schon kurz nach seiner erstmaligen Charakterisierung von Sulfolobus acidocaldarius im Jahr 1972 beschrieb T. Brock, dass sich dieser Mikroorganismus mit Pili und Flagellen an Steinen in den heißen Quellen anheftete [1]. Diese Zellextensionen sind in elektronenmikroskopischen Aufnahmen gut zu erkennen (Abb. 1).
Analyse der Zelloberflächenstrukturen
In S. solfataricus wurden bisher drei verschiedene Zelloberflächenstrukturen beschrieben: Flagellen, das Bindosom und UV-Licht-induzierbare Pili [2]. Die Assemblierung und Funktion dieser Strukturen sollen im Folgenden beschrieben werden (Abb. 2).
Weitere Funktionen der Pili
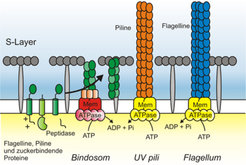
Für halophile und methanogene Archaeen wurde demonstriert, dass Flagellen Motilität in Flüssigmedien ermöglichen. Eine Flagellen-Deletionsmutante von S. solfataricus konnte nicht mehr auf Oberflächen schwärmen. Auch die Adhäsion an organische und anorganische Oberflächen war in dieser Flagellenmutante inhibiert [3].
Ein weiteres Pili-System kommt nur nach der Bestrahlung von S. solfataricus mit UV-Licht zur Expression. Neben den zu erwartenden DNA-Reparaturgenen wird ein Operon hochreguliert, das Untereinheiten eines Pilus-Assemblierungssystems kodiert. Die Bildung dieser Pili an der Zelloberfläche bewirkt eine gerichtete Zellaggregation, die dazu führt, dass bis zu 90% der bestrahlten Zellen nach sechs Stunden in großen Aggregaten vorliegen. Diese Aggregate lösen sich nach ungefähr zehn Stunden wieder auf [4]. Es wurde kürzlich demonstriert, dass UV-Licht in Sulfolobus Spezies die Rekombinationsrate um mehrere Größenordnungen erhöht. Daher wird postuliert, dass das UV-induzierbare Pilisystem ein neuartiges DNA-Austausch-System darstellt.
Das dritte in S. solfataricus beschriebene System ist das Bindosom. Dieses System ist bisher einzigartig für diesen Organismus. Hier formen zuckerbindende Proteine einen Komplex in der Zellwand, der es S. solfataricus ermöglicht, Zucker auch bei niedrigsten Konzentrationen effektiv aufzunehmen. Auch für diese zuckerbindenden Proteine wurde ein membranassoziiertes System identifiziert, das für die korrekte Assemblierung dieser Proteine zur aktiven Teilnahme am Transportprozess notwendig ist [5].
Erforschung des molekularen Aufbaus der Assemblierungssysteme
Alle drei beschriebenen Assemblierungssysteme werden durch sehr wenige Untereinheiten aufgebaut, deren Herzstück durch eine membranassoziierte ATPase und ein integrales Membranprotein geformt wird. Diese zwei Untereinheiten der drei verschiedenen Assemblierungssysteme sind nicht nur untereinander homolog, sondern zeigen auch hohe Ähnlichkeiten zu Komponenten von bakteriellen Typ IV-Pili-Systemen. Die Homologien sind nicht nur auf die ATPase und das zentrale Membranprotein beschränkt, sondern beinhalten auch die strukturellen Untereinheiten: Flagelline, UV Piline und zuckerbindenden Proteine. Alle drei Genprodukte werden als Präprotein exprimiert und enthalten ein spezielles Signalpeptid, das bisher nur in Typ IV-Pili bekannt war. Das Signalpeptid wird nach der Insertion des Proteins in die Zytoplasmamembran durch eine spezifische Peptidase abgetrennt; danach kann das Pilin in die jeweilige Zelloberflächenstruktur wie das Flagellum oder den Pilus eingegliedert werden. In Homologie zum bakteriellen System wurde die archaeale Type IV-Pilinpeptidase als eine Aspartat-Peptidase identifiziert [6].
In Struktur-Untersuchungen bakterieller Typ IV-Pili wurde gezeigt, dass die hydrophobe Domäne des Signalpeptids, die am prozessierten Pilin verbleibt, essenziell für die Assemblierung des Filaments ist. Eine entsprechende hydrophobe Domäne verbleibt auch nach Prozessierung an den archaealen Pilinen und es wird daher angenommen, dass hydrophobe N-termini bei Archaeen ebenso wie bei Bakterien eine große Rolle in der Assemblierung der jeweiligen Oberflächenstruktur spielen.
Die Analyse von Deletionsmutanten des zentralen ATPase- und Membranproteins der verschiedenen Assemblierungsmaschinen von Sulfolobus hat gezeigt, dass in den meisten Fällen nur diese zwei Proteine und ein bis zwei Pilin-Untereinheiten notwendig sind, um ein funktionelles Filament zu formen [4, 5]. Im Gegensatz zu Typ IV-Pili in Gram-negativen Bakterien, in denen bis zu 15 verschiedene Proteine eine Rolle bei der Assemblierung des Pilus spielen, stellen die archaealen Assemblierungssysteme also sehr vereinfachte Systeme dar [7]. Darum wird die detaillierte Analyse des Assemblierungsmechanismus des archaealen Systems nicht nur diesen Mechanismus selbst aufklären, sondern auch dazu beitragen, wichtige Fragen zur Assemblierung bakterieller Filamente zu beantworten.
Die Analyse aller sequenzierter archaealer Genome hat gezeigt, dass alle Archaeen putative Pili-Untereinheiten besitzen, von denen viele auch in Operonstrukturen mit potenziellen Assemblierungssystemen vorkommen [8]. Das lässt den Schluss zu, dass Archaeen in der Lage sind, viele noch nicht identifizierte Oberflächenstrukturen zu bilden, deren Aufbau, Assemblierung und Funktion in den folgenden Jahren aufgeklärt werden sollen.

